Objectifs d’apprentissage
À la fin de ce sujet, l’étudiante devrait être en mesure :
- de décrire le système opioïde endogène et ses fonctions physiologiques.
- de décrire le mécanisme d’action des agonistes opioïdes.
- d’expliquer comment les opioïdes agissent au niveau du système nerveux central et comment cela peut induire des troubles liés à l’utilisation d’opioïdes.
- d’acquérir des connaissances préliminaires au sujet de la neuroscience associée à l’utilisation d’opioïdes.
Concepts clés
- Le cerveau produit plusieurs peptides agonistes opioïdes endogènes qui activent trois récepteurs : µ (mu), δ (delta) et κ (kappa).
- Le système opioïde exerce son action sur plusieurs mécanismes physiologiques, dont la régulation de la douleur.
- Au niveau du système nerveux central, les récepteurs opioïdes jouent un rôle dans la signalisation du système de récompense, ce qui peut influencer l’apparition d’un trouble lié à l’utilisation d’opioïdes.
- Il existe des traitements et thérapies pour les troubles liés à l’utilisation d’opioïdes, incluant le traitement par agoniste aux opioïdes (TAO).
- Bien que plusieurs zones du cerveau contiennent des récepteurs opioïdes, lorsqu’il est question de troubles liés à l’utilisation d’opioïdes, on se concentre davantage sur l’aire tegmentale ventrale (ATV), le noyau accumbens (NAc) et le locus coeruleus (LC).
Opioïdes endogènes
Lorsqu’ils pensent aux opioïdes, la plupart des gens imaginent automatiquement des médicaments ou des drogues non réglementés. En fait, le corps humain produit des opioïdes lors de ses processus naturels de neurorégulation. Les opioïdes produits par le corps sont considérés comme étant endogènes. Ceci contraste avec les opioïdes exogènes, qui sont généralement utilisés pour des raisons médicales ou autres. Les opioïdes exogènes sont soit dérivés de plantes ou synthétiques.
Testez vos connaissances
Combien d’opioïdes le cerveau humain produit-il (opioïdes endogènes)?
Types d’opioïdes endogènes
Les opioïdes synthétiques ou d’origine végétale sont tous des molécules organiques; les opioïdes endogènes, par contre, consistent en de petits peptides (c.-à-d. des composés d’acides aminés). Ces peptides opioïdes sont dérivés de plus grosses protéines (préproopiomélanocortine, préproenképhaline et préprodynorphine).
Il y a trois principaux types de peptides opioïdes :
- endorphines;
- enképhalines;
- dynorphines.
Récepteurs d’opioïdes dans le corps
Les peptides opioïdes endogènes et les opioïdes exogènes (médicaments, drogues) agissent principalement par l’entremise de trois récepteurs opioïdes, soit :
- µ (mu),
- δ (delta), et
- κ (kappa).
Bien que les trois récepteurs opioïdes s’expriment partout dans l’organisme et dans de nombreux systèmes, les récepteurs mu sont parfois qualifiés de supraspinaux, car ils induisent de nombreux effets au cerveau, agissant notamment sur le système de récompense (le système limbique).
Les opioïdes peuvent être des agonistes complets, qui activent les récepteurs opioïdes au maximum, ou des agonistes partiels, qui ne les activent qu’en partie.
Exemples d’agonistes complets :
- morphine,
- oxycodone,
- fentanyl et plusieurs autres.
Exemple d’agoniste partiel :
- La buprénorphine
Mécanisme d’action – Douleur
Les opioïdes sont surtout employés pour leurs effets analgésiques (soulagement de la douleur) sur les douleurs modérées à graves provenant de diverses sources.
La douleur est signalée au cerveau par l’activation de la voie ascendante de la douleur.
- La voie ascendante de la douleur transmet le signal de douleur de sa source vers le cerveau.
- L’activation des récepteurs opioïdes inhibe cette voie.
Le corps humain (incluant le système opioïde) est en mesure d’atténuer la douleur en activant la voie descendante inhibitrice. Descendante parce que la voie débute au cerveau et fait son chemin jusqu’à la moelle épinière. Inhibitrice parce que cette voie inhibe les signaux de douleur ascendants.
Le système de recompense du cerveau
Le système limbique comprend diverses parties du cerveau qui contrôlent ou ont un impact sur les émotions, le désir et la mémoire, entre autres éléments.

Richfield, D. (2015). Mesolimbic Pathway. Wikimedia. https://commons.wikimedia.org/wiki/File:Mesolimbic_pathway.svg and licensed under (CC BY-SA 4.0).
Le système limbique comprend aussi une structure (nucleus accumbens) parfois appelée le « centre du plaisir », puisqu’il est lié aux notions de récompense, de renforcement et d’aversion. Diverses activités apportant un certain niveau de plaisir (p. ex., la drogue, le sexe, les jeux de hasard, les jeux vidéo) activent le système de récompense et libèrent de la dopamine, un neurotransmetteur.

Les substances comme la nicotine, les opioïdes et autres stimulent le centre du plaisir pendant que le système limbique s’attarde à la consolidation de mémoires. Le résultat? Un souvenir des actions, des personnes présentes, et du lieu associés à l’activation du centre du plaisir. Le fait d’activer le centre du plaisir et de créer de telles mémoires peut avoir un effet sur le désir de retrouver ces mêmes récompenses à l’avenir.
Remarque :La biologie derrière le fonctionnement du système limbique est l’un des éléments clés pour déterminer si une activité qui apporte un certain niveau de plaisir (pensez à l’utilisation de substances) va constituer une expérience unique, une activité occasionnelle, une activité régulière ou une activité menant possiblement à une dépendance ou à un trouble lié à l’utilisation de substances.
Pour en savoir plus sur la génétique et l’épigénétique de l’utilisation d’opioïdes et des troubles liés à l’utilisation d’opioïdes, consultez le Module 1, Indicateur D.
Traitement des troubles liés à l’utilisation d’opioïdes
La thérapie ou le traitement par agonistes opioïdes (TAO) est la principale thérapie utilisée contre les troubles liés à l’utilisation d’opioïdes ou l’utilisation problématique d’opioïdes.
- Cette thérapie vise notamment à remplacer l’utilisation problématique d’opioïdes par une utilisation régulière d’opioïdes bien précis en doses définies, tel que prescrit par un médecin, tout en évitant les symptômes de sevrage.
Composés utilisés pour la TAO
Methadone
La méthadone est un opioïde à action prolongée et un agoniste complet des récepteurs opioïdes.
Buprénorphine
La buprénorphine est un agoniste partiel des récepteurs opioïdes; elle active ces récepteurs, mais pas totalement. Ainsi, en présence d’un agoniste complet, elle agit comme un bloqueur de récepteurs opioïdes et peut même induire des symptômes de sevrage des opioïdes.
L’efficacité du TAO

- Selon certaines mesures effectuées lors d’essais cliniques (73 % de rétention pour le groupe traité, contre 22 % pour le groupe ayant reçu un placebo), la méthadone donne de meilleurs résultats que la buprénorphine/naloxone (64 % de rétention pour le groupe traité, contre 39 % pour le groupe ayant reçu un placebo) (Amato et al., 2013).
- Au Canada, la buprénorphine/naloxone est utilisée comme TAO en première instance (Bruneau et al., 2018) compte tenu de son efficacité et de sa sécurité établies, et aussi parce qu’elle n’exige pas de formation additionnelle pour le prescripteur, comme la méthadone.
Autres traitements pour le trouble lié à l’utilisation d’opioïdes
En plus de la TAO, de nouvelles thérapies pharmacologiques, des traitements fondés sur la thérapie, des groupes de soutien, des cliniques de traitement de la toxicomanie à accès rapide, des traitements en établissement et d’autres traitements démontrent différents degrés d’efficacité (Bruneau et al., 2018; Leshner et Mancher, 2019; Taha, 2018).
- Des formulations de morphine orale à libération prolongée sont employées (au Canada, elles sont habituellement utilisées après l’essai de buprénorphine/naloxone et de méthadone).
- Le naltrexone (généralement à libération prolongée) est un antagoniste des récepteurs opioïdes qui, comme la naloxone, diminue le sentiment de manque (par rapport aux opioïdes et aux autres drogues, incluant l’alcool) et est souvent utilisé lors du rétablissement.
- La TAO est habituellement jumelée à une thérapie cognitivo-comportementale, à une thérapie comportementale, à des méthodes d’organisation des contingences ou à des techniques d’entrevue motivationnelle.
Prenez un moment pour lire le texte suivant, qui présente un rétablissement réussi : l’histoire de Paul (en anglais seulement).
Neurosciences et utilisation d’opioïdes
Nous allons revoir comment les opioïdes affectent le cerveau, de même que les concepts de base liés à la tolérance et au sevrage d’opioïdes.
Les opioïdes circulent dans le sang avant d’arriver au cerveau. Une fois dans le cerveau, ils lient les récepteurs opioïdes à la surface des neurones sensibles aux opiacés.
Bien que plusieurs zones du cerveau contiennent des récepteurs opioïdes, lorsqu’il est question de troubles liés à l’utilisation d’opioïdes, on se concentre davantage sur les trois régions suivantes :
- l’aire tegmentale ventrale (ATV),
- le noyau accumbens (NAc) et
- le locus coeruleus (LC).
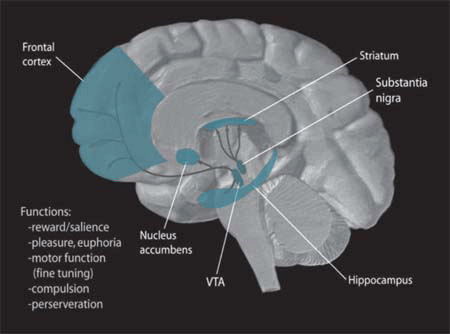
In the brain, dopamine plays an important role in the regulation of reward and movement. As part of the reward pathway, dopamine is manufactured in nerve cell bodies located within the ventral tegmental area (VTA) and is released in the nucleus accumbens and the prefrontal cortex. Its motor functions are linked to a separate pathway, with cell bodies in the substantia nigra that manufacture and release dopamine into the striatum.
NIDA. (2006). Dopamine Pathways [Image]. Wikimedia. https://commons.wikimedia.org/wiki/File:Dopamine_Pathways.png

Diego69. (2010). Locus Coeruleus [Image]. Wikimedia. https://commons.wikimedia.org/wiki/File:Locus-coeruleus.gif and licensed under (CC BY-SA 3.0
Nous allons explorer, un à la fois, les processus et structures impliqués dans l’usage d’opioïdes.
- L’ATV et le NAc font partie du système de récompense mésolimbique (mésencéphale). Les signaux opioïdes activent l’ATV, qui relâche la dopamine chimique (DA) dans le NAc, ce qui cause une sensation d’euphorie. Ce plaisir est généralement ce qui encourage l’utilisation continue d’opioïdes.
- Au fil du temps, les récepteurs opioïdes peuvent se désensibiliser; il faut donc une dose supérieure pour stimuler les cellules cérébrales de l’ATV et causer le relâchement de la même quantité de DA dans le NAc.En d’autres mots, une plus grande dose d’opioïdes est requise pour générer un plaisir équivalent.
- Les neurones du LC produisent de la noradrénaline (NA, aussi appelée norépinéphrine, NE), qui régule l’état de veille, la respiration, la pression artérielle et le métabolisme, entre autres fonctions. Dans le LC, les opioïdes inhibent l’émission de NA, ce qui provoque des symptômes comme la fatigue, le ralentissement du rythme respiratoire et la baisse de la tension artérielle. Cependant, après une exposition répétée aux opioïdes, les neurones du LC compensent l’effet répressif des opioïdes par une émission accrue de NA. Par conséquent, lorsqu’aucun opioïde n’est là pour réfréner l’activité accrue des neurones du LC (l’émission accrue de NA), la concentration excessive de NA provoque de l’agitation, de l’anxiété, des crampes musculaires et de la diarrhée.
- L’exposition répétée à des doses toujours plus fortes d’opioïdes entraîne des effets progressifs, mais durables sur le cerveau. Par exemple, pour contrer l’augmentation de dopamine induite par l’utilisation d’opioïdes, le cerveau réduit naturellement sa production de dopamine par l’intermédiaire du système de récompense mésolimbique. Le résultat? L’utilisateur ressent moins de plaisir lors d’activités quotidiennes qui étaient habituellement une source de plaisir.
Ces changements neurochimiques peuvent entraîner une dépendance, surtout lorsque les individus comptent sur l’effet des opioïdes pour fonctionner normalement au quotidien.
Les interventions pharmacologiques impliquent l’introduction de molécules qui lient les récepteurs opioïdes, p. ex., la méthadone et la buprénorphine, mais produisent différents effets.
L’importance des histoires de rétablissement

dusanpetkovic/iStock
Les histoires de rétablissement doivent être racontées, et ce, pour plusieurs raisons. Elles peuvent remettre en question la conception dominante ou répandue quant à l’image des toxicomanes. Les histoires de rétablissement :
- donnent de l’espoir à autrui,
- constituent un témoignage oral ou écrit du courage et de la résilience liés au processus de rétablissement, et
- permettent de toucher ceux qui assistent ensuite au rétablissement de la personne.
Ceux qui se confient peuvent exprimer leur sentiment de contrôle et de maîtrise sur un phénomène qui dominait auparavant leur destinée ou leur vie.
Ces histoires de rétablissement permettent également à une personne de créer son propre récit, un processus qui peut s’avérer très valorisant, mais aussi de contextualiser les facteurs intrapersonnels, interpersonnels, sociétaux, culturels et politiques qui ont contribué à son trouble lié à l’utilisation de substances.
C’est particulièrement important pour les membres de peuples autochtones et de groupes marginalisés. Les effets du colonialisme, le racisme, l’oppression et d’autres facteurs distaux contribuent aux troubles liés à l’utilisation de substances.
La section suivante contient deux histoires racontées par des personnes qui défient les stéréotypes de la victime d’une dépendance et de son processus de rétablissement.
Histoires vécues de rétablissement
La première histoire est celle de Tara Conner, ancienne Miss USA 2006, qui milite maintenant en faveur du rétablissement et s’adresse aux foules de partout aux États-Unis:
Le deuxième récit porte sur un médecin qui a choisi de rester anonyme. Son histoire de rétablissement met l’accent sur le chevauchement de multiples aspects : le travail, la vie quotidienne, la famille, la pratique professionnelle, les amis et la communauté.
Prenez un moment pour lire l’article A Personal Story of Addiction (en anglais seulement).
Pause réflexion/Question menant à la réflexion
Maintenant que vous avez lu ce contenu, considérez ce qui suit :
Choisissez l’une des histoires de rétablissement présentées dans ce module. Réfléchissez à l’effet qu’elle pourrait produire chez une personne aux prises avec un trouble lié à l’utilisation d’opioïdes.
Questions
Références
Amato, L., Minozzi, S., Davoli, M., et Vecchi, S. (2013). Psychosocial combined with agonist maintenance treatments versus agonist maintenance treatments alone for treatment of opioid dependence. Cochrane Database of Systematic Reviews, 10, CD004147.
Bruneau, J., Ahamad, K., Goyer, M.-E., Poulin, G., Selby, P., Fischer, B., Wild, C., et Wood, E. (2018). Management of opioid use disorders: A national clinical practice guideline. Canadian Medical Association Journal, 190, E247–E257.
Brunton, L. L., Hilal-Dandan, R., et Knollmann, B. C. Goodman and Gilman’s the pharmacological basis of therapeutics (13e édition). McGraw-Hill Education.
Hammer, R. R., Dingel, M. J., Ostergren, J. E., Nowakowski, K. E., et Koenig, B. A. (2012). The experience of addiction as told by the addicted: Incorporating biological understandings into self-story. Culture, Medicine and Psychiatry, 36(4), 712–734. https://doi.org/10.1007/s11013-012-9283-x
Katzung, B. G. (2018). Basic and clinical pharmacology (14e édition). McGraw-Hill Education.
Kosten, T. R., et George, T. P. (2002). The neurobiology of opioid dependence: Implications for treatment. Science & Practice Perspectives, 1(1), 13–20. https://doi.org/10.1151/spp021113
Leshner, A. I., et Mander, M. (éditeurs). (2019). Medications for opioid use disorder save lives. A consensus study report. National Academies of Sciences, Engineering, Medicine.
Taha, S. (2018). Best practices across the continuum of care for the treatment of opioid use disorder. Centre canadien sur les dépendances et l’usage de substances.
Wang, S.-C., Chen, Y.-C., Lee, C.-H., Cheng, C.-M. (2019). Opioid addiction, genetic susceptibility, and medical treatments: A review. International Journal of Molecular Sciences, 20, 4294.
Wiklund, L. (2008). Existential aspects of living with addiction–Part 1: Meeting challenges. Journal of Clinical Nursing, 17(8), 2426–2434.https://doi.org/10.1111/j.1365-2702.2008.02356.x