Objectifs d’apprentissage
À la fin de ce sujet, l’étudiante ou l’étudiant devrait être en mesure :
- de comprendre le mécanisme d’action des opioïdes;
- de décrire les indications médicales en lien avec l’usage d’opioïdes à court terme;
- de décrire les indications médicales en lien avec l’utilisation d’opioïdes à plus long terme;
- de nommer les types d’interactions médicamenteuses associées aux opioïdes, ainsi que leurs conséquences;
- de discuter de la tolérance, de la dépendance et du sevrage que peut provoquer l’usage d’opioïdes.
Concepts clés
- Le cerveau produit plusieurs peptides opioïdes qui activent trois récepteurs : μ (mu), δ (delta) et κ (kappa) qui, ensemble, constituent le système opioïde.
- Le système opioïde exerce son action sur plusieurs mécanismes physiologiques, dont la régulation de la douleur.
- Les opioïdes, dont les effets s’apparentent à ceux de la morphine, activent les récepteurs opioïdes.
- Les opioïdes servent à traiter la douleur aiguë, la douleur chronique chez les gens atteints de cancer ainsi que d’autres formes de douleur chronique.
- Les opioïdes servent également à des fins récréatives, y compris l’automédication, et à traiter les symptômes de sevrage d’opioïdes.
- Les effets nocifs des opioïdes comprennent la fatigue extrême, les nausées, la constipation et les démangeaisons cutanées. La dépression respiratoire est l’effet indésirable le plus grave et potentiellement mortel (la dépression respiratoire et son renversement par la naloxone sont abordés dans Module 8, Indicateur E).
- L’usage à long terme d’opioïdes peut entraîner des effets indésirables, comme des troubles du sommeil et des changements hormonaux.
- Les opioïdes peuvent interagir avec d’autres médicaments, comme les dépresseurs du système nerveux central, qui augmentent le risque de conséquences indésirables, dont la dépression respiratoire/surdose.
- L’usage continu d’opioïdes peut entraîner une tolérance. Une tolérance est constatée lorsqu’une personne doit augmenter sa dose d’opioïdes pour obtenir le même effet.
- L’usage continu d’opioïdes peut provoquer une dépendance. Une personne dépendante aux opioïdes présentera des symptômes de sevrage si elle cesse brusquement d’en consommer.
Opioïdes : les bases
Lorsqu’ils pensent aux opioïdes, la plupart des gens imaginent automatiquement des médicaments ou des drogues non réglementés. En fait, le corps produit plus de 20 opioïdes de par ses processus neurorégulateurs naturels. Ces opioïdes sont appelés opioïdes endogènes, par comparaison aux opioïdes exogènes, ceux utilisés pour des raisons médicinales ou autres. Les opioïdes exogènes sont d’origine synthétique ou végétale.
Types d’opioïdes endogènes
Les opioïdes synthétiques ou d’origine végétale sont tous des molécules organiques; les opioïdes endogènes, par contre, consistent en de petits peptides (c.-à-d. qu’ils se composent d’acides aminés). Ces peptides opioïdes sont dérivés de plus grosses protéines (préproopiomélanocortine, préproenképhaline et préprodynorphine).
Il y a trois principaux types de peptides opioïdes :
- endorphines;
- enképhalines;
- dynorphines.
Récepteurs opioïdes dans le corps humain
Tant les peptides opioïdes endogènes que les opioïdes exogènes (médicaments, drogues) agissent principalement par l’entremise de trois récepteurs opioïdes :
- µ (mu);
- δ (delta); et
- κ (kappa).
Bien que les trois récepteurs opioïdes s’expriment partout dans l’organisme et dans de nombreux systèmes, les récepteurs mu sont parfois qualifiés de supraspinaux, car ils induisent de nombreux effets au cerveau, agissant notamment sur le système de récompense (soit le système limbique).
La plupart des opioïdes sont considérés comme des agonistes complets, c’est-à-dire qu’ils activent les récepteurs opioïdes au maximum. Certains sont des agonistes partiels, qui n’activent les récepteurs qu’en partie.
Exemples d’agoniste complet :
- morphine;
- oxycodone;
- fentanyl.
Exemple d’agoniste partiel :
- buprénorphine
Comment les opioïdes traitent-ils la douleur?
Les opioïdes sont surtout employés pour leurs effets analgésiques (soulagement de la douleur) sur les douleurs modérées à graves provenant de diverses sources.
La douleur est signalée au cerveau par l’activation de la voie ascendante de la douleur.
- La voie ascendante de la douleur transmet le signal de douleur de sa source vers le cerveau.
- L’activation des récepteurs opioïdes inhibe cette voie.
Le corps humain (incluant le système opioïde) est en mesure d’atténuer la douleur en activant la voie descendante inhibitrice. Comme cette voie est orientée du cerveau vers la moelle épinière, elle fonctionne dans le sens contraire de la voie ascendante de la douleur. Elle inhibe le signal douloureux ascendant.
Usage d’opioïdes à court terme

Les opioïdes sont surtout employés pour leurs effets analgésiques (soulagement de la douleur) sur les douleurs modérées à graves provenant de diverses sources.
Les opioïdes soulagent la douleur en :
- bloquant la transmission de la douleur de son point d’origine vers le cerveau, via la moelle épinière;
- accroissant l’activité de la voie descendante inhibitrice, aussi dans la moelle épinière, pour atténuer davantage la douleur;
- diminuant la perception subjective de la douleur (c.-à-d. en induisant une tolérance accrue à la douleur).
Plus rarement, les opioïdes sont utilisés comme traitement de la diarrhée ou pour contrôler une forte toux. Ils sont également utilisés en soins palliatifs pour des cas de dyspnée (respiration difficile ou laborieuse).
Les opioïdes sont aussi employés en combinaison avec d’autres médicaments en anesthésie, pour les interventions chirurgicales et médicales.
Les effets nocifs associés à l’utilisation d’opioïdes à court terme peuvent inclure la fatigue extrême, la somnolence, les nausées et les vomissements, la constipation, les démangeaisons, etc. Pour en savoir plus, voir le Module 8, Indicateur B.
La réaction indésirable la plus grave, la dépression respiratoire, ainsi que son renversement par la naloxone, sont abordés au Module 8, Indicateur E.
Usage d’opioïdes à long terme

Si les opioïdes servent à traiter une grande variété de types de douleur aiguë, leur utilisation et leur efficacité pour soulager la majorité des types de douleur chronique ne font pas l’unanimité.
- Les opioïdes servent fréquemment à contrôler la douleur chronique chez les personnes atteintes de cancer.
- Bien que les opioïdes soient parfois prescrits pour la douleur chronique non cancéreuse, ils sont souvent jugés moins efficaces au fil du temps.
- D’autres traitements, comme les analgésiques non opioïdes, dont l’acétaminophène et les médicaments anti-inflammatoires non stéroïdiens (AINS), devraient d’abord être envisagés. De plus, on recourt davantage aux antidépresseurs et aux anticonvulsivants pour traiter la douleur neurogène chronique.
- Si l’on utilise des opioïdes pour traiter la douleur chronique, les pratiques exemplaires suggèrent de maintenir les doses quotidiennes en deçà de 90 DME (dose équivalente en morphine), si possible, de vérifier fréquemment l’efficacité et les effets indésirables, ainsi que d’éviter l’usage d’autres dépresseurs du système nerveux central, et surtout des benzodiazépines, comme le diazépam (Valium).
En plus des effets indésirables associés à l’usage à court terme, l’usage à long terme d’opioïdes peut causer ces effets :
- hyperalgésie (lorsque les opioïdes intensifient la douleur plutôt que de la diminuer);
- tolérance;
- dépendance et sevrage;
- troubles liés à l’utilisation d’opioïdes.
L’usage à long terme d’opioïdes est aussi lié à ces phénomènes :
- changements hormonaux qui affectent l’humeur et provoquent une dysfonction sexuelle;
- aménorrhée (l’absence de menstruations);
- gynécomastie (hypertrophie mammaire).
Opioïdes et interactions médicamenteuses
Les interactions médicamenteuses peuvent être classées par types : pharmacocinétiques, pharmacologiques/pharmacodynamiques et physiologiques.
Interactions médicamenteuses pharmacocinétiques
Définition
- Interactions médicamenteuses pharmacocinétiques
- Une interaction médicamenteuse pharmacocinétique se produit lorsqu’un médicament modifie l’absorption, la distribution dans l’organisme, le métabolisme ou l’excrétion d’un autre médicament, soit autant de processus susceptibles d’altérer l’effet de ce dernier.
Si une interaction médicamenteuse pharmacocinétique augmente la concentration d’opioïdes, la personne risque de subir des effets indésirables accrus ou plus intenses, dont une dépression respiratoire.
Si une interaction médicamenteuse pharmacocinétique réduit la concentration d’opioïdes, une réduction du contrôle de la douleur ou des symptômes de sevrage peuvent se manifester chez la personne.
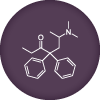
La méthadone est métabolisée par une enzyme du foie appelée CYP3A4.
- L’antidépresseur fluvoxamine inhibe l’activité de CYP3A4, ce qui provoque une augmentation de la concentration de méthadone.
- Certains anticonvulsivants peuvent induire 3A4 (augmenter le nombre d’enzymes) et faire chuter la concentration de méthadone.
Interactions médicamenteuses pharmacologiques/pharmacodynamiques
Une interaction médicamenteuse pharmacologique/pharmacodynamique survient lorsque deux médicaments agissent sur le même récepteur.
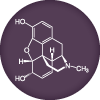
La morphine active les récepteurs opioïdes et la naloxone les bloque.
Interactions médicamenteuses physiologiques
Une interaction médicamenteuse physiologique se produit lorsque deux médicaments ont des effets similaires ou opposés sur l’organisme. Par exemple, l’un augmente la pression artérielle, alors que l’autre la réduit; ces deux médicaments ont un effet physiologique opposé.

Les propriétés sédatives/dépressives du SNC peuvent se combiner aux effets engendrés par d’autres dépresseurs du SNC, dont l’alcool, les benzodiazépines et les barbituriques, qui dépriment également le système respiratoire.
Souvent, les dépresseurs du SNC agissent en synergie pour causer la fatigue extrême ou la dépression respiratoire.
Tolérance
Comme tous les systèmes du corps humain, le système opioïde s’autorégule : lorsque le système devient hyperactif, l’organisme prend les mesures nécessaires pour limiter l’activité; dans le cas contraire, des mesures s’enclenchent pour augmenter l’activité.
Définition
- Opioïdes exogènes
- Opioïdes provenant d’une source externe plutôt que produits par l’organisme.
À la prise d’opioïdes exogènes, le système opioïde endogène détecte la suractivité qui en découle et réagit en la réduisant. Pour ce faire, il diminue la production de peptides opioïdes endogènes et le nombre de récepteurs opioïdes, entre autres actions.
- L’organisme commence son adaptation à la présence de l’opioïde exogène.
- o Cette adaptation peut s’accompagner d’une certaine tolérance : la personne aura alors besoin d’une quantité croissante de la drogue pour obtenir le même effet.
Lorsque la consommation d’opioïdes cesse, le système opioïde revient, au fil du temps, à son état initial.
Dépendance et sevrage
Avec un usage continu, l’activité du système opioïde endogène pourrait se voir de plus en plus perturbée. Tôt ou tard, cette activité est réduite au point où l’organisme devient dépendant aux opioïdes exogènes fournis en continu, ce qu’on appelle la dépendance aux opioïdes.
Une personne dépendante aux opioïdes subira des symptômes de sevrage si elle en cesse l’usage. Le délai d’apparition de ces symptômes dépend de la demi-vie de l’opioïde utilisé :

Tzido/iStock
- douleurs et faiblesse musculaires;
- diarrhée et crampes abdominales;
- nausées et vomissements;
- frissons et chair de poule;
- bâillements;
- transpiration, changements dans la température du corps;
- anxiété;
- agitation;
- éternuements et écoulement nasal;
- fréquence cardiaque rapide;
- perturbations du sommeil.
Si ces symptômes se manifestent, ils sont aussitôt annulés par une nouvelle dose d’opioïde. Les symptômes de sevrage peuvent être atténués par une réduction graduelle de la dose.
La gravité du sevrage s’évalue cliniquement à l’aide de la grille d’évaluation de sevrage (COWS, ou Clinical Opiate Withdrawal Scale) (Wesson et Ling, 2003).
Questions
Pourquoi le passage de la méthadone à la buprénorphine pourrait-il provoquer des symptômes de sevrage?
Feedback
La méthadone est un agoniste complet (100 %) des récepteurs opioïdes. La buprénorphine est un agoniste partiel. La buprénorphine active les récepteurs opioïdes, mais seulement en partie (disons à 50 %). Donc, si quelqu’un prenait de la buprénorphine uniquement, l’activation des récepteurs opioïdes passerait du point de référence (0) à 50 %. Cependant, en présence d’un agoniste complet, la buprénorphine réduit l’activation des récepteurs opioïdes (présumons de 100 % à environ 50 %) et peut précipiter l’apparition de symptômes de sevrage. Par conséquent, le passage de la méthadone à la buprénorphine requiert un examen, un dosage et un synchronisme minutieux.
Références
Brunton, L. L., Hilal-Dandan, R. et Knollmann, B. C. (2018). Goodman and Gilman’s the pharmacological basis of therapeutics (13é ed.). McGraw-Hill Education.
DiPiro, J. T., Yee, G. C. L., Posey, M., Haines, S. T., Nolin, T. D. et Ellingrod, V. (2019). Pharmacotherapy: A pathophysiologic approach (11th ed.). McGraw-Hill Education.
Katzung, B. G. (2018). Basic and clinical pharmacology (14é ed.). McGraw-Hill Education.
McCance-Katz, E. F., Sullivan, L. et Nallani, S. (2010). Drug interactions of clinical importance among the opioids, methadone and buprenorphine, and other frequently prescribed medications: A review. American Journal on Addictions, 19, pp. 4–16.
Wesson, D. R. et Ling, W. (2003). The Clinical Opiate Withdrawal Scale (COWS). Journal of Psychoactive Drugs, 35, pp. 253–259.